当研究室では、原始的な不完全変態昆虫であるコオロギ (フタホシコオロギ Gryllus bimaculatus) を主な研究材料として研究を進めています。
なぜコオロギを研究材料とするのか?
これまで、昆虫の神経生物学はモデル生物であるショウジョウバエを中心に進められてきました。コオロギはショウジョウバエとはおよそ4億年前に分岐した不完全変態昆虫(多新翅亜節 バッタ目 キリギリス亜目)に属し、鳴き声によるコミュニケーションなどの顕著な社会行動を示します。当研究室では以下に示すコオロギの強みを生かして、分子生物学・遺伝学的アプローチを活用した研究を進めています。
1. 実験室内での安定的な集団飼育が容易で遺伝学実験に適した近交系を樹立している
2. ゲノム配列が既知で、網羅的かつ詳細な遺伝子発現解析が可能
3. 受精卵への顕微微量注入による遺伝子導入やゲノム編集技術が容易に適用できる
コオロギに加えて、ワモンゴキブリやクロゴキブリなどのゴキブリ科昆虫を対象に、
性フェロモン受容機構の研究も進めています。不完全変態 vs 完全変態
昆虫はおよそ5億年の進化の過程で発達様式を大きく変化させてきました。最も原始的な系統に属するイシノミやシミなどの無翅昆虫は無変態昆虫(ametabolous insects)とも呼ばれ、ミジンコなどと同様に孵化後、体制を変化させずに脱皮を繰り返して成長します。無変態昆虫は性成熟後も脱皮を繰り返すことが知られています。
次に原始的な系統は翅を獲得した不完全変態昆虫(hemimetabolous insects)です。彼らは幼虫期には未発達な翅の原基(翅芽)を持ち、成虫脱皮時に翅芽を発達させて機能的な翅を形成します。翅以外の形態は幼虫期・成虫期を通して一部の例外(例えばトンボやカゲロウなどの水生昆虫)を除いて共通点が多く、無変態昆虫のように成虫脱皮(性成熟)後に脱皮を繰り返すことはありません。
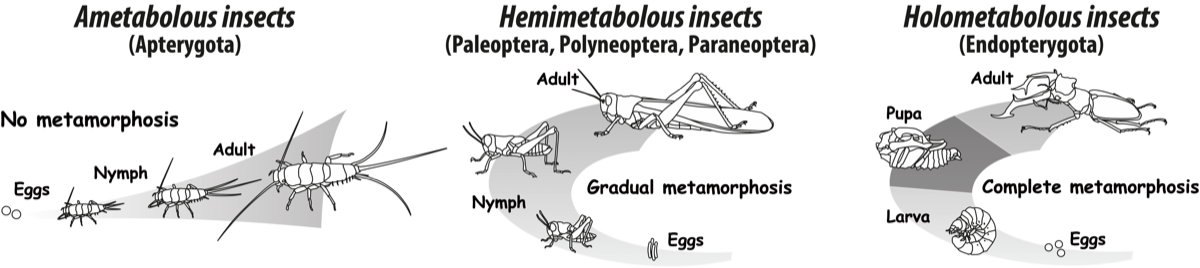
最も派生的な系統は、ショウジョウバエに代表される完全変態昆虫(holometabolous insects)で、幼虫期と成虫期の間に蛹期をもつことが最大の特徴です。幼虫期の完全変態昆虫は未発達な脚部をもち、外部に露出した翅芽を持ちません。また複眼を持たず、触角などの感覚器官も未発達です。これらの成虫で見られる器官は
成虫原器と呼ばれる構造として幼虫体内に保持されます。幼虫は脱皮を繰り返して成長し、終齢幼虫は前蛹を経由して蛹へと変態します。蛹の中では幼虫期の組織・構造が分解され、成虫原基より成虫特異的な構造が形成されます。完全変態昆虫の脳では蛹期に大規模な構造的再編成が起こることが知られています。下図はミツバチ脳の蛹期の構造的再編成の過程を示したもので、9日間の蛹期の間にキノコ体などの神経叢が大きく発達することがわかります。コオロギなどの蛹期を持たない不完全変態昆虫の脳において、このような大規模な構造的再編成は起こらないと考えられますが、不完全変態昆虫の神経系でも幼虫期から成虫期へと移行する過程で何らかの再編成が起こり、成虫期に見られる配偶行動や飛翔に係る神経回路網が整備されるのだろうと考えています。
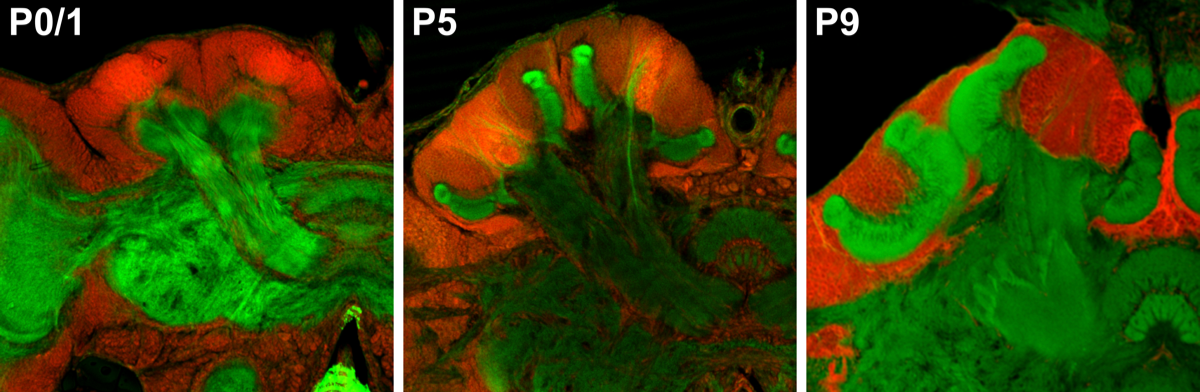
当研究室では、不完全変態昆虫において幼虫から成虫への移行に際して起こるであろう脳・神経回路の再編成を単一ニューロンレベルの解像度で可視化し、その機能的意義を理解するために
神経遺伝学的なアプローチを武器に研究を進めています。フタホシコオロギ
Gryllus bimaculatus
分子遺伝学研究を進めるにあたり、基準となる系統を整備する必要が生じます。当研究室では50年近く実験室内で飼育された野生型近交系を元に、雄雌1ペアより系統を立ち上げて野生型系統(Hokudai WT 系統)として維持しています。また、Hokudai WT 系統と自然突然変異により生じた白眼系統(gwhite 系統)とを戻し交配した白眼系統(Hokudai gwhite 系統)も樹立しています。
実験室内ではコオロギは約1ヶ月半の世代時間で継代飼育が可能です。また多くの日本原産のコオロギ類とは異なり、温暖な地中海原産のフタホシコオロギは休眠期を持たないため一年中繁殖し、実験に必要な発生ステージの個体をいつでも準備することができます。
当研究室では、比較研究のためフタホシコオロギ以外にもさまざまなコオロギを試験的に飼育し、ゲノム解析などに利用しています。
参考文献
- Watanabe T.*, Ugajin A., Aonuma H.. (2018). Immediate-early promoter-driven transgenic reporter system for neuroethological researches in a hemimetabolous insect. eNeuro. 5:e0061-18.2018.
- Ylla G., Nakamura T., Itoh T. et al. (2021). Insights into the genomic evolution of insects from cricket genomes. Commun Biol 4:733.
- Watanabe T., Takeuchi H., Kubo T.. (2010). Structural diversity and evolution of the N-terminal isoform-specific region of ecdysone receptor-A and -B1 isoforms in insects. BMC Evol Biol. 10:40.